Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В.А. Рабиновича и Х.М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Задачи 175-205
175. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l=2? l=3? Решение
176. Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n=4? Решение
177. Определить по правилу Клечковского последовательность заполнения электронных орбиталей, характеризующихся суммой n+l: а) 5; б) 6; в) 7. Решение с ключом
178. Указать порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбитали 4d; б) начинается заполнение подуровня 4p. Решение
179. Какой подуровень заполняется в атомах после подуровня 5s? Решение с ключом
180. У какого элемента начинает заполняться подуровень 4f? У какого элемента завершается заполнение этого подуровня?
181. Какой подуровень заполняется в атомах после заполнения подуровня 5p? После заполнения подуровня 5d? Решение с ключом
182. Записать электронные формулы атомов элементов с зарядом ядра: а) 8; б) 13; в) 18; г) 23; д) 53; е) 63; ж) 83. Составить графические схемы заполнения электронами валентных орбиталей этих атомов. Решение
183. Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а) 1p3; б) 3p6; в) 3s2; г) 2s2; д) 2d5; е) 5d2; ж) 3f12; з) 2p4; и) 3p7. Решение
184. Сколько вакантных 3d-орбиталей имеют возбужденные атомы: а) Cl; б) V; в) Mn? Решение
185. Сколько неспаренных электронов содержат невозбужденные атомы: a) B; б) S; в) As; г) Cr; д) Hg; е) Eu? Решение с ключом
186. Составить электронно-графические схемы ионов Fe2+ и Fe3+. Чем можно объяснить особую устойчивость электронной конфигурации иона Fe3+? Решение с ключом
187. Указать особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов? Решение
188. Структура валентного электронного слоя атома элемента выражается формулой: а) 5s25p4; б) 3d54s1. Определить порядковый номер и название элемента. Решение
189. Электронная структура атома описывается формулой 1s22s22p63s23p63d64s2. Какой это элемент? Решение
190. Написать электронные формулы ионов: а) Sn2+; б) Sn4+; в) Mn2+; г) Cu2+; д) Cr3+; е) S2-. Решение
191. У элементов каких периодов электроны внешнего слоя характеризуются значением n+l=5? Решение
192. Перечислить электронные аналоги среди элементов VI группы периодической системы элементов. Написать в общем виде электронные формулы валентных электронных подуровней атомов этих элементов. Решение
193. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах? Решение
194. Почему медь имеет меньший атомный объем, чем калий, расположенный в той же группе и том же периоде? Решение
195. Для атома углерода значения последовательных потенциалов ионизации составляют (в В): I1=11,3, I2=24,4, I3=47,9, I4=64, I5=392. Объяснить: а) ход изменения потенциалов ионизации; б) чем вызван резкий скачок при переходе от I4 к I5. Решение с ключом
196. Энергии ионизации атомов благородных газов составляют (в эВ): He - 24,6; Ne - 21,6; Ar - 15,8; Kr - 14,0; Xe - 12,1; Rn - 10,8. Объяснить ход изменения энергии ионизации в этой подгруппе. Решение
197. Значения первых потенциалов ионизации элементов I группы периодической системы элементов соответственно равны (в В): Li - 5,4; Cs - 3,9; Cu - 7,7; Ag - 9,2. Указать: а) у элементов какой подгруппы I группы металлические свойства выражены более резко; б) чем объяснить различный ход изменения значений потенциалов ионизации в подгруппах. Решение
198. Одинакова ли энергия ионизации атома цезия и атома лития, у которого валентный электрон предварительно возбужден на 6s-подуровень? Ответ обосновать. Решение
199. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода? Чем объяснить, что первый потенциал ионизации атома Be больше, чем атомов Li и B? Решение
200. Объяснить ход изменения энергии ионизации (в эВ) в ряду Mg-Al-Si:
| Mg | Al | Si | |
| I1 | 7,6 | 6,0 | 8,2 |
| I2 | 15,0 | 18,8 | 16,3 |
| I3 | 80,1 | 28,4 | 33,5 |
Решение
201. Каков физический смысл обычно изображаемых атомных орбиталей:
s  и p
и p 
а) поверхность равной электронной плотности, внутри которой заключена произвольная часть электронного облака; б) траектория движения электрона; в) поверхность, внутри которой заключено электронное облако; г) поверхность равной электронной плотности, внутри которой заключена определенная часть электронного облака? Решение
202. Как зависит энергия электрона в многоэлектронном атоме от орбитального квантового числа при постоянном значении главного квантового числа: а) увеличивается с ростом l; б) уменьшается с ростом l; в) остается неизменной? Потому что: 1) размеры электронного облака определяются только значением главного квантового числа (n); 2) при одном и том же n электроны с большим значением l сильнее экранируются внутренними электронами; 3) с увеличением l степень вырождения подуровня растет. Решение
203. Как изменяются значения первых потенциалов ионизации в ряду элементов Li, Be, B, C, N, O, F, Ne: а) увеличиваются; б) уменьшаются; в) изменяются нерегулярно, но имеют тенденцию к возрастанию? Решение
204. У какого из атомов первый потенциал ионизации выше - у бериллия или у бора: а) у Be; б) у B? Потому что: 1) при переходе от Be к B возрастает заряд ядра; 2) электронные конфигурации с полностью заполненным подуровнем обладают повышенной устойчивостью; 3) при переходе от Be к B уменьшается размер атома. Решение
205. Какая из приведенных электронных конфигураций нормального состояния атома является правильной:
а) 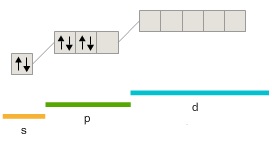 |
в) 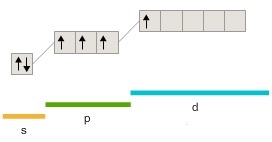 |
б) 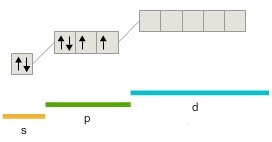 |
г) 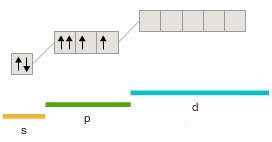 |
Потому что: 1) в случаях... нарушено правило Хунда; 2) в случаях... нарушен принцип Паули; 3) в случаях... энергия атома не минимальна. Решение